-
乙醇 编辑
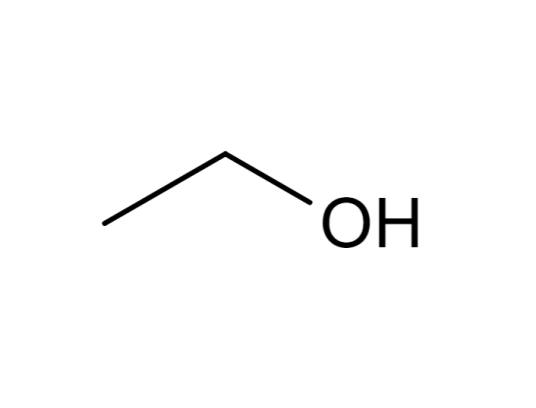
乙醇(ethanol)是一种有机化合物,结构简式为CHCHOH或CHOH,分子式为CHO,俗称酒精。
乙醇在常温常压下是一种易挥发的无色透明液体,低毒性,纯液体不可直接饮用。乙醇的水溶液具有酒香的气味,并略带刺激性,味甘。乙醇易燃,其蒸气能与空气形成爆炸性混合物。乙醇能与水以任意比互溶,能与氯仿、乙醚、甲醇、丙酮和其他多数有机溶剂混溶。
乙醇可用于制造醋酸、饮料、香精、染料、燃料等,医疗上常用体积分数为70%~75%的乙醇作消毒剂。乙醇在化学工业、医疗卫生、食品工业、农业生产等领域都有广泛的用途。
中文名:乙醇
外文名:ethanolethylalcohol
别名:酒精、火酒
化学式:C2H5OH
分子量:46.07
CAS登录号:64-17-5
EINECS登录号:200-578-6
熔点:-114.1℃(常压)
沸点:78.3℃(常压)
密度:0.7893g/cm³(20℃)
外观:无色透明液体,有芳香气味
闪点:14.0℃(闭杯);21.1(开杯)
应用:化学工业、医疗卫生、食品工业、农业生产等
安全性描述:S7;S16;S24/25;S26;S36/37;S45;S61
危险性符号:F
危险性描述:R11
UN危险货物编号:1170
CN危险货物编号:32061
危险标记:7(易燃液体)
爆炸极限:3.3%~19%
蒸气压:5.333kPa(19℃)
解离系数:pKa=15.9(25℃)
粘度:1.074mPa·s(20℃)
气体密度:2.009kg/m³
临界温度:516.2K
临界压力:6.38MPa
相对蒸气密度:1.59(空气=1)
同分异构体:二甲醚
折射率:1.3611(20℃)
溶解性:与水混溶,可混溶于乙醚、氯仿、甘油、甲醇等多数有机溶剂
酒是古老的人造饮料,经考古发现,早在原始社会时期,人类就知道用谷物、瓜果发酵酿酒。中国是世界上最早酿酒的国家之一,甲骨文中就已经出现了“酒”字和与酒有关的“醴”“尊”“酉”等字。中国最晚在夏代已能人工造酒,《战国策》中记载“帝女令仪狄造酒,进之于禹”。殷商时期,中国已摆脱原始酿酒的方法,开始进入制曲酿酒阶段。周代酿酒已发展成独立且具有相当规模的手工业作坊。最初的酒是果酒和米酒。夏之后,经商周、历秦汉,以至于唐宋,都是以果实或粮食蒸煮,加曲发酵,经压榨、过滤后制得的酒。随着人类的进步发展,酿酒工艺也在原来基础上进一步发展,通过蒸馏提高了酒精的浓度,出现蒸馏酒。中国古人已发现酒在药用方面的价值,《汉书·食货志》中说:“酒,百药之长。”《本草纲目》认为:“酒少饮则和血行气,痛饮则伤神耗血,损胃之精,生痰动火。”
西方的酒品主要是谷物酒,长期沿用麦芽糖化加酵母的酿造法。直到19世纪90年代,法国人卡尔迈特从中国引进酒曲,从中分离出糖化力强并能起糖化作用的霉菌菌株,应用于酒精生产上,才突破了西方以麦芽糖化剂酿酒的传统工艺。关于酒的药用,19世纪医学家用白兰地治疗心衰和伤寒等症,生理学家和药理学家开始对酒精的药理作用进行研究,发现酒精能影响鸟的中枢神经活动,抑制蛙和哺乳动物的心跳,影响狗的胃肠消化吸收功能。
人们对酒含有的主要成分——乙醇的认识也在逐步发展。1784年,法国化学家安托万-洛朗·拉瓦锡(AntoineLaurent LAVoisier,1743—1794)首先测定了乙醇的元素成分。1807年,瑞士化学家尼古拉斯·泰奥多尔·索绪尔(Nicolas Theodore de Saussure,1767—1845)首先完成了乙醇的元素组成分析,确定了乙醇的化学式。1858年,英国化学家斯科特·库珀(Archibald Scott Couper,1831—1892)提出了乙醇最初的结构式,即库珀图解式。1825年,英国化学家迈克尔·法拉第(Michael Faraday,1791—1867)首次以合成方式制备乙醇。
乙醇的工业化生产从19世纪末开始发展起来,到第二次世界大战期间发酵法生产乙醇达到了高峰。发酵法是经典的乙醇生产方法,在相当长的时期里是乙醇的主要来源。但是发酵法受到原料来源和成本高的限制,因此合成法逐渐兴起。间接水合法制乙醇早在1825年就有报道,但直到1930年才由美国联合碳化物公司实现工业化。由于间接水合法要消耗大量的浓硫酸,生产过程中的硫酸介质对设备有严重腐蚀而且产品分离提纯困难,自1932年起美国和前苏联同时开始了直接水合法的研究。1945年,美国壳牌化学公司把磷酸吸附在颗粒状硅藻土上,制备成固体催化剂,解决了直接水合法的催化剂问题。20世纪50年代末,原联邦德国维巴化学公司在壳牌法基础上改进了催化剂。到20世纪60年代,美国伊斯特曼-柯达公司又在水合工艺方面进行了改进。20世纪60年代后期,前苏联对水合催化剂进行了改进,最后确定为磷酸-硅藻土催化剂。乙醇的生产方法除发酵法和合成法外,合成气制乙醇技术和甲醇同系化法也在开发中。
物理性质
乙醇是带有一个羟基的饱和一元醇,可以看成是乙烷分子中的一个氢原子被羟基取代的产物,或者是水分子中的一个氢原子被乙基取代的产物。乙醇分子是由C、H、O三种原子构成的极性分子,其中C、O原子均以sp³杂化轨道成键。 乙醇在常温常压下是一种无色透明、易挥发、易燃烧、不导电的液体,它的水溶液具有酒香的气味,味甘。在20 ℃常温下,乙醇液体密度是0.7893 g/cm3。乙醇的熔点是-114.1 ℃,沸点是78.3 ℃。乙醇蒸气能与空气形成爆炸性混合物。 20 ℃下,乙醇的折射率为1.3611。 乙醇还是一种良好的溶剂,能与水以任意比互溶,可混溶于氯仿、乙醚、乙酸、甲醇、丙酮、甘油等多数有机溶剂。 当乙醇与水混合时其体积减小,1体积的乙醇与1体积的水混合后其体积只有1.92体积,而当乙醇与汽油混合时总体积则增大。乙醇的物理性质主要与其低碳直链醇的性质有关。分子中的羟基可以形成氢键,因此乙醇具有潮解性,可以很快从空气中吸收水分。 分子间氢键的存在也使得乙醇的沸点高于相对分子质量相近的烷烃。乙醇分子中羟基的极性使得很多离子化合物可溶于乙醇中,如氢氧化钠、氢氧化钾、氯化镁、氯化钙、氯化铵、溴化铵和溴化钠等;但氯化钠和氯化钾微溶于乙醇。 非极性的烃基使得乙醇也可溶解一些非极性的物质,例如大多数香精油和很多增味剂、增色剂和医药试剂。乙醇还可与水、乙腈、苯、丁酮、丁醛、四氯化碳、氯仿、环己烷、1,2-二氯乙烷、乙酸乙酯、乙基丁基醚、己烷、乙酸异丙酯、异丙醚、乙酸甲酯、甲基环己烷、硝基甲烷、甲苯、三氯乙烯等形成二元共沸物,使得它们不能通过蒸馏的方法进行分离。
性质 | 数据 | 性质 | 数据 | 性质 | 数据 |
|---|---|---|---|---|---|
熔点(常压) | -114.1 ℃ | 黏度(30 ℃) | 0.5142 mPa·s | van der Waals面积 | 4.930×109 cm2·mol-1 |
沸点(常压) | 78.3 ℃ | 蒸发热(沸点) | 38.95 kJ/mol | van der Waals体积 | 31.940 cm3·mol-1 |
密度(20 ℃) | 0.7893 g/cm3 | 熔化热 | 104.7 kJ/kg | 气相标准燃烧热 | 1410.01 kJ·mol-1 |
饱和蒸气压(20 ℃) | 5.8 kPa | 生成热(液体) | -277.8 kJ/mol | 气相标准生成热 | -234.01 kJ·mol-1 |
燃烧热 | -1365.5 kJ/mol | 比热容(20 ℃,定压) | 2.42 kJ/(kg·K) | 气相标准熵 | 280.64 J·mol-1·K-1 |
临界温度 | 243.1 ℃ | 沸点上升常数 | 1.03~1.09 | 气相标准生成自由能 | -166.7 kJ·mol-1 |
临界压力 | 6383.48 kPa | 电导率 | 1.35×10-19 S/m | 气相标准热容 | 65.21 J·mol-1·K-1 |
辛醇/水分配系数 | 0.32 | 热导率 | 18.00 W/(m·K) | 液相标准燃烧热 | -1367.54 kJ·mol-1 |
闪点(闭杯) | 14.0 ℃ | 体膨胀系数(20 ℃) | 0.00108 K-1 | 液相标准生成热 | -276.98 kJ·mol-1 |
闪点(开杯) | 21.1 ℃ | 临界密度 | 0.275 g/cm3 | 液相标准熵 | 161.04 J·mol-1·K-1 |
引燃温度 | 363 ℃ | 临界体积 | 168 cm3·mol-1 | 液相标准生成自由能 | -174.18 kJ·mol-1 |
爆炸上限 | 19.0% | 临界压缩因子 | 0.241 | 液相标准热容 | 112.6 J·mol-1·K-1 |
爆炸下限 | 3.3% | 偏心因子 | 0.637 | 折射率(20 ℃) | 1.3611 |
黏度(15 ℃) | 0.6405 mPa·s | Lennard-Jones参数(A) | 4.5564 | 电偶极矩(25 ℃) | 5.67×10-30 C·M |
黏度(20 ℃) | 0.5945 mPa·s | Lennard-Jones参数(K) | 424.51 | 磁化率(20 ℃) | 7.34×10-7 |
黏度(25 ℃) | 0.5525 mPa·s | 溶度参数 | 26.421 (J·cm-3)0.5 | 介电常数(20 ℃) | 25.7 |
化学性质
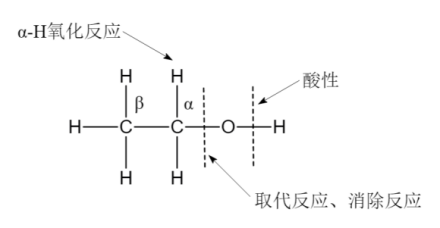
乙醇的官能团是羟基(—OH),其化学性质主要由羟基和受它影响的相邻基团决定,主要反应形式是О—H键和C—О键的断裂。羟基的结构特征是氧的电负性很大,分子中的C—О键和O—H键都是极性键,因而乙醇分子中有2个反应中心。由于α-H和β-H受到C—О键极性的影响具有一定的活性,因此它们还能发生氧化反应和消除反应等。1.酸碱性
乙醇具有弱酸性(严格来说不具有酸性,因为不能使酸碱指示剂变色),因含有极化的氧氢键,故电离时会生成烷氧基负离子和质子。其电离方程式为:
乙醇的pKa=15.9(25 ℃),与水相近,电离平衡足以使乙醇与重水之间迅速发生同位素交换。其化学反应式为:
2.与金属反应
钾、钙、钠等活泼金属可将乙醇羟基里的氢置换出来,生成醇盐和氢气,但不如和水反应剧烈。以乙醇与钠的反应为例,产物乙醇钠遇水可发生水解,生成乙醇和氢氧化钠,因此乙醇钠的水溶液呈强碱性。其化学反应式为:
3.氧化反应
乙醇的燃烧反应是广义上的氧化反应。乙醇完全燃烧时发出淡蓝色火焰,生成二氧化碳和水蒸气,并放出大量的热。其化学反应式为:
乙醇不完全燃烧时生成一氧化碳,有黄色火焰,放出热量。其化学反应式为:
在有机化学中,氧化反应特指加氧或去氢的反应。 乙醇可以发生脱氢反应,被氧化成为乙醛。其化学反应式为:
该反应可用于工业制乙醛。在人体内则可以通过乙醇脱氢酶(alcohol dehydrogenase,ADH)作用使乙醇变成乙醛。
乙醇也可被高锰酸钾氧化成乙酸,同时高锰酸钾由紫红色变为无色。其化学反应式为:
乙醇也可与酸化的三氧化铬溶液(或酸性重铬酸钾溶液)反应,当乙醇蒸气进入含有酸化的三氧化铬(或酸性重铬酸钾溶液)的硅胶中时,可见硅胶由黄色变成草绿色,该反应可用于检验司机是否饮酒驾车。其化学反应式为:
强氧化剂如高锰酸钾及重铬酸钾都能将乙醇直接氧化成乙酸,反应不能停留在生成乙醛的阶段。使用特殊的氧化剂,如Sarrett试剂,可使反应停留在乙醛的阶段。Sarrett试剂是三氧化铬与吡啶形成的配合物
4.酯化反应
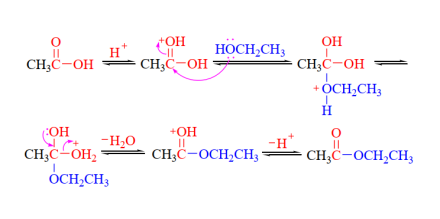
乙醇与无机含氧酸(如硝酸、亚硝酸、硫酸和磷酸等)之间脱水,可生成相应的无机酸酯。以硝酸为例,其化学反应式为:
该反应可逆,在相同条件下,乙酸乙酯水解生成乙酸和乙醇的反应称为乙酸乙酯的水解反应。为提高酯的产率,可适当增大反应物浓度或将生成的酯和水不断蒸出反应体系,使平衡向右移动。
5.醇解反应
乙醇可与羧酸衍生物如酰卤、酸酐、酯等发生醇解反应生成相应的酯,难易程度不同。
酰卤活性很高,醇解反应进行较快。以乙酰氯为例,其化学反应式为:
酸酐的醇解比酰卤缓和,反应中可用适量的酸或碱进行催化,是制备酯的常用方法。以乙酸酐为例,其化学反应式为:
酯的醇解反应可逆,需要在酸或碱的催化下进行,反应中从一个酯生成另一个新的酯,所以该反应也叫做酯交换反应。以乙酸甲酯为例,其化学反应式为:
6.卤化反应
乙醇可以和氢卤酸发生取代反应,生成卤代烃和水。其化学反应通式为:
反应活性顺序:
乙醇也可与卤化磷(PX3、PX5)反应生成卤代烃,该方法更为常用。其化学反应通式为:
乙醇与PX5的反应,因副产物磷酸酯比较多,产物分离较为困难,因此不是制备卤代烃的好办法。实际工作中,三卤化磷常用卤素单质与磷的反应产生:
乙醇还可与氯化亚砜反应生成氯乙烷,其化学反应式为:
用氯化亚砜作为卤代试剂,副产物二氧化硫和氯化氢很容易离开反应体系,产物容易分离和纯化。
7.脱水反应
乙醇在酸性条件下加热可发生脱水反应。乙醇脱水可按两种方式进行:一种是乙醇分子内脱一分子水生成烯烃(消除反应);另一种是两个分子的乙醇发生分子间脱水生成乙醚(亲核取代反应)。
乙醇在催化剂存在的条件下加热,分子内消去一个水分子,生成乙烯。该反应属于消除反应,其化学反应式为:
常用的催化剂还有磷酸、氧化铝等。进行该反应时要在烧瓶中加入碎瓷片或沸石以免暴沸。
两分子乙醇也可以发生分子间脱水而生成乙醚。其化学反应式为:
乙醇的消除反应和成醚反应都是在酸的作用下进行,二者是并存和相互竞争的。较低的温度下有利于成醚反应,而在高温条件下有利于消除反应生成烯烃。若能控制好反应条件,可以使其中一种产物为主要产物。
由于分子间脱水成醚的副反应较多,一般较少用于醚的合成。更加常用的是Williamson合成法,即用醇钠或酚钠与卤代烃反应,既可合成对称醚,也可合成不对称醚。以合成甲乙醚为例,其化学反应式为:
8.卤仿反应
乙醛、甲基酮与次卤酸盐反应生成卤仿和少一个碳的羧酸盐的反应称为卤仿反应。由于乙醇在次卤酸盐条件下可氧化生成乙醛,故它也能发生卤仿反应。乙醇与次氯酸钠反应生成氯仿,溴仿和碘仿也可以分别由乙醇与次溴酸钠和次碘酸钠反应得到。在低碳醇中,只有乙醇才能进行卤仿反应。以乙醇与次碘酸钠反应为例,其过程如下:
疏水参数计算参考值(XlogP):-0.1
氢键供体数量:1
氢键受体数量:1
可旋转化学键数量:0
互变异构体数量:0
拓扑分子极性表面积:20.2
重原子数量:3
表面电荷:0
复杂度:2.8
同位素原子数量:0
确定原子立构中心数量:0
不确定原子立构中心数量:0
确定化学键立构中心数量:0
不确定化学键立构中心数量:0
共价键单元数量:1
1、按生产使用的原料可分为淀粉质原料发酵酒精、糖蜜原料发酵酒精、亚硫酸盐纸浆废液发酵生产酒精。
(1)淀粉质原料发酵酒精:一般有薯类、谷类和野生植物等含淀粉质的原料,在微生物作用下将淀粉水解为葡萄糖,再进一步由酵母发酵生成酒精;
(2)蜜原料发酵酒精:直接利用糖蜜中的糖分,经过稀释杀菌并添加部分营养盐,借酵母的作用发酵生成酒精;
(3)亚硫酸盐纸浆废液发酵生产酒精:利用造纸废液中含有的六碳糖,在酵母作用下发酵成酒精,主要产品为工业用酒精,也有用木屑稀酸水解制作的酒精。
2、按生产的方法来分,可分为发酵法酒精和合成法酒精两大类。
3、按产品质量或性质来分,又分为高纯度酒精、无水酒精、普通酒精和变性酒精。
4、按产品系列分:GB 394-1981(已废止)曾将酒精分为优级、一级、二级、三级和四级,其中一、二级相当于高纯度酒精及普通精馏酒精,三级相当于医药酒精,四级相当于工业酒精。现行的GB/T 394.1-2008将工业酒精分为优级、一级、二级和粗酒精四类。现行的GB 10343-2008将食用酒精分为特级、优级和普通级三类。
工业制备
工业上一般用发酵法、合成法和联合生物加工法制取乙醇。
发酵法
发酵法是用淀粉原料(如谷类、薯类、玉米、高粱或野生植物果实)和糖质原料(如糖蜜、亚硫酸废液)等发酵,前者是主要的发酵原料。发酵法是在酿酒基础上发展起来的,在相当长的历史时期内,曾是生产乙醇的唯一工业方法。在这个过程中,发生了一系列复杂的生化反应。以淀粉原料为例,整个生产过程包括原料蒸煮、糖化剂制备、糖化、酒母制备、发酵及蒸馏等工序。原料中的可溶性淀粉在酶的作用下水解为糖,再经过酵母菌发酵生成乙醇并放出二氧化碳(用糖质原料不需经过淀粉水解成葡萄糖这一步)。发酵液中乙醇的质量分数约为6%~10%,再经蒸馏工艺将乙醇浓缩为大约95.57%的酒精溶液。生产过程中的主要化学反应式为:
合成法
随着近代有机工业的发展,可利用炼焦油、石油裂解所得的乙烯来合成乙醇。该法中的原料乙烯,可大量取自石油裂解气,成本低,产量大,并且能大量节约粮食。化学合成法有直接水合法和间接水合法两种,工业上普遍采用前者。
(1)直接水合法:乙烯与水蒸气在有机磷催化剂存在的条件下,经高温高压作用,可直接发生加成反应生成酒精。该法步骤简单,无腐蚀问题,但要求原料气中乙烯纯度在98%以上,需采用特殊的方法分离裂解其中的各种成分,对设备、材料都提出了较高要求。其化学反应式为:
(2)间接水合法:又称为硫酸水合法,是用硫酸与乙烯经加成作用生成硫酸氢乙酯,再进行水解,生成乙醇和硫酸。该法对原料气体的纯度要求不高,设备简化。缺点是对设备腐蚀严重,酸消耗多。其化学反应式为:
3联合生物加工法
生物转化使用的原料大多为粮食作物,大量使用会影响到粮食安全,而利用生物能源转化技术生产乙醇,可缓解非再生化石能源日渐枯竭带来的能源压力。因秸秆、麸皮、锯木粉等农业、工业废弃物含有大量的木质纤维素,所以来源广泛的纤维素是很有潜力的生产乙醇的原料。另外,在生物燃料的生产过程中,纤维素的预处理和纤维素酶的生产成本较高,故减少预处理,增强纤维素酶活性,提高发酵产物的产量和纯度,减少中间环节也是降低生产成本的途径。联合生物加工不包括纤维素酶的生产和分离过程,而是把糖化和发酵结合到由微生物介导的一个反应体系中,因此与其他工艺过程相比较,底物和原料的消耗相对较低,一体化程度较高。这种综合方法的未来发展前景广阔。
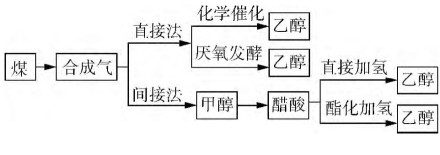
此外,近年来有文献报道了煤制乙醇的方法。煤制乙醇是以煤为原料经气化为合成气或者以工厂废气(主要成分均为一氧化碳和氢气)为原料,生产乙醇。目前,以煤为源头生产燃料乙醇的工艺路线主要包括四条,都需要首先将煤气化为合成气。从合成气生产燃料乙醇主要有两种方法,即直接法和间接法。直接法可由两条工艺路线实现:合成气化学催化路线和合成气厌氧发酵路线。间接法制乙醇是先采用成熟的甲醇合成技术,将合成气转化为甲醇,然后再将甲醇羰基化为醋酸,最后再进行醋酸直接加氢或者将醋酸酯化后加氢生产乙醇。实验室制备
乙醇是常用的有机溶剂,在许多有机化学反应中,无论是作为反应物还是溶剂,乙醇的纯度有时都对化学反应有着很大的影响。市售普通工业酒精是含95.6%乙醇和4.4%水的恒沸混合物,其沸点为78.15 ℃,用蒸馏的方法不能将乙醇中的水完全除去。若要得到含量较高的乙醇,可以把工业酒精与生石灰在一起进行加热回流,使乙醇中的水分与氧化钙充分反应,生成不挥发性的氢氧化钙而除去。然后再采用蒸馏的方法把乙醇蒸出,这样得到的乙醇的纯度可达99.5%。其化学反应式为:
若要得到纯度更高的无水乙醇,可用金属镁进行处理,也可用分子筛法进行制取。
医疗用品
95%的酒精可用于擦拭紫外线灯。这种酒精在医院常用,在家庭中则只会将其用于相机镜头的清洁。
70%~75%的酒精可用于消毒。若酒精浓度过高,会在细菌表面形成一层保护膜,阻止其进入细菌体内,难以将细菌彻底杀死。若酒精浓度过低,虽可进入细菌,但不能将其体内的蛋白质凝固,同样也不能将细菌彻底杀死。因此75%的酒精消毒效果最好。
40%~50%的酒精可用于预防褥疮。长期卧床患者的背、腰、臀部因长期受压可引发褥疮,如按摩时将少许40%~50%的酒精倒入手中,均匀地按摩患者受压部位,就能达到促进局部血液循环,防止褥疮形成的目的。
25%~50%的酒精可用于物理退热。高烧患者可用其擦身,达到降温的目的。用酒精擦拭皮肤,能使患者的皮肤血管扩张,增加皮肤的散热能力,酒精蒸发吸热,使病人体表温度降低,症状缓解。
需要注意的是,酒精浓度不可过高,否则可能会刺激皮肤,并大量吸收表皮的水分。
食品饮料
乙醇是酒的主要成分,含量和酒的种类有关系。需要注意的是,饮用酒中的乙醇不是把乙醇加进去,而是微生物发酵得到的乙醇,根据使用微生物的种类不同还会有乙酸或糖等有关物质。
乙醇还可用于制造醋酸、饮料、焙烤食品、糖果、冰淇淋、沙司等。
有机原料
乙醇也是基本的有机化工原料,可用来制取乙醛、乙酸、乙醚、乙酸乙酯、乙胺等化工原料,也是制取溶剂、染料、涂料、香精、农药、医药、橡胶、塑料、人造纤维、洗涤剂等产品的原料。
有机溶剂
乙醇可与水及多数有机溶剂混溶,被广泛用作有机化学反应的溶剂及黏合剂、硝基喷漆、清漆、化妆品、油墨、脱漆剂等的溶剂。
乙醇也是液体制剂的常用溶剂,用于合剂、酊剂及注射剂中。乙醇的极性比水小,能溶解中药中的中等极性、弱极性、非极性成分,如生物碱及其盐类、苷类、挥发油、树脂、鞣质、有机酸和亲脂性色素等。中医常用酒精泡制药酒,送服中药,以使药物效果得到更大的发挥;也利用其防腐作用,用作存放和保管物品。
由于叶绿体中的色素能溶在无水乙醇中,所以生物学上常用无水乙醇提取叶绿体中的色素。
汽车燃料
乙醇可单独作为汽车燃料,也可与汽油混合作为混合燃料。 在汽油中添加5%~20%燃料乙醇制成乙醇汽油,可减少汽车尾气对空气的污染。另外,乙醇还可以作为抗爆剂添加到汽油中以代替四乙基铅。
环境危害
危险性:易挥发,易燃烧,刺激性。其蒸气与空气混合成爆炸性气体。遇到高热、明火能燃烧或爆炸,与氧化剂铬酸、次氯酸钙、过氧化氢、硝酸、硝酸银、过氯酸盐等反应剧烈,有发生燃烧爆炸的危险。在火场中,受热的容器有爆炸危险。其蒸气比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。
健康危害
侵入途径:吸入、食入、经皮吸收。
健康危害:本品为中枢神经系统抑制剂。首先引起兴奋,随后抑制。
急性中毒:急性中毒多发生于口服。一般可分为兴奋、催眠、麻醉、窒息四个阶段。患者进入第三或第四阶段,出现意识丧失、瞳孔扩大、呼吸不规律、休克、心力循环衰竭及呼吸停止。
慢性影响:在生产中长期接触高浓度乙醇可引起鼻、眼、黏膜刺激症状以及头痛、头晕、疲乏、易激动、震颤、恶心等。长期酗酒可引起多发性神经病、慢性胃炎、脂肪肝、肝硬化、心肌损害及器质性精神病等。皮肤长期接触可引起干燥、脱屑、皲裂和皮炎。
环境标准
乙醇的环境标准如下:
苏联 | 乙醇在生产区的临界量 | 2 t |
乙醇在贮存区的临界量 | 20 t | |
车间空气中有害物质的最高允许浓度 | 1000 mg/m3 | |
苏联(1977) | 大气质量标准 | 5.0 mg/m3 |
嗅觉阈浓度 | 50 mg/L |
防护措施
工程控制:密闭操作,加强通风。
呼吸系统防护:一般不需要特殊防护,高浓度接触时可佩带过滤式防毒面具(半面罩)。
眼睛防护:戴化学安全防护眼镜。
身体防护:穿防静电的胶布防毒衣。
手防护:戴一般作业防护手套(橡胶手套)。
其他防护:工作完毕,淋浴更衣。保持良好的卫生习惯。
泄露应急处置
迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿消防防护服。尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄漏:用砂土或其他不燃材料吸附或吸收。也可用大量水冲洗,洗水稀释后放入废水系统。
大量泄漏:构筑围堤或挖坑收容;用泡沫覆盖,降低蒸气灾害。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
1、毒性
微毒。
2、急性毒性
LD50 7060 mg/kg(兔经口);LD50 7340 mg/kg(兔经皮);LC50 37620 mg/m³,10 h(大鼠吸入);人吸入4.3 mg/L,50 min,头面部发热,四肢发凉,头痛;人吸入2.6 mg/L,39 min,头痛,无后作用。
3、刺激性
家兔经眼,500 mg,重度刺激。家兔经皮开放性刺激试验:15 mg/24 h,轻度刺激。
4、亚急性和慢性毒性
大鼠经口10.2 g/(kg·d)、12周:体重下降,脂肪肝。
5、致突变性
微生物致突变:鼠伤寒沙门氏菌阴性。
显性致死试验:小鼠经口1~1.5 g/(kg·d),2周,阳性。
6、生殖毒性
大鼠腹腔最低中毒浓度(TDL0):7.5 g/kg(孕9天),致畸阳性。
7、致癌性
小鼠经口最低中毒剂量(TDL0):340 mg/kg(57周,间断),致癌阳性。
性状
本品为无色澄清液体,微有特臭,易挥发,易燃烧,燃烧时显淡蓝色火焰,加热至约78°C即沸腾。
本品与水、甘油、三氯甲烧或乙酶能任意混溶。
相对密度
本品的相对密度(通则0601)不大于0.8129,相当于含C2H6O不少于95.0%(mL/mL)。
鉴别
1、取本品1mL,加水5mL与氢氧化钠试液1mL后,缓缓滴加典试液2mL,即发生碘仿的臭气,并生成黄色沉淀。
2、本品的红外光吸收图谱应与对照的图谱(光谱集1290图)一致。
检查
酸碱度
取本品20mL,加水20mL,摇匀,滴加酚酞指示液2滴,溶液应为无色,再加0.01mol/L氢氧化钠溶液1.0mL,溶液应显粉红色。
溶液的澄清度与颜色
本品应澄清无色,取本品适量,与同体积的水混合后,溶液应澄清,在10°C放置30分钟,溶液仍应澄清。
吸光度
取本品,以水为空白,照紫外-可见分光光度法(通则0401)测定吸光度,在240nm的波长处不得过0.08;250~260nm的波长范围内不得过0.06,270~340nm的波长范围内不得过0.02。
挥发性杂质
照气相色谱法测定法(通则0521)测定。
供试品溶液(1):取本品,即得。
供试品溶液(2):精密量取4-甲基-2-戊醇150µL,置20mL量瓶中,用本品稀释至刻度,摇匀,精密量取1mL,置25mL量瓶中,用本品稀释至刻度,摇匀,精密量取1mL,置25mL量瓶中,用本品稀释至刻度,摇匀。
对照溶液(1):精密量取无水甲醇100µL,置50mL量瓶中,用本品稀释至刻度,摇匀,精密最取5mL,置50mL量瓶中,用本品稀释至刻度,摇匀,精密最取5mL,置50mL量瓶中,用本品稀释至刻度,摇匀。
对照溶液(2):精密量取无水甲醇1mL,乙醛1mL,置10mL量瓶中,用本品稀释至刻度,摇匀,精密量取10μL,置10mL量瓶中,用本品稀释至刻度,摇匀,再精密量取10μL,置10mL量瓶中,用本品稀释至刻度,摇匀。
对照溶液(3):精密量取乙缩醛150µL,置50mL量瓶中,用本品稀释至刻度,摇匀,精密量取100µL,置10mL量瓶中,用本品稀释至刻度,摇匀。
对照溶液(4):精密量取苯50µL,置50mL量瓶中,用本品稀释至刻度,摇匀,精密量取50µL,置25mL量瓶中,用本品稀释至刻度,摇匀。
色谱条件:以6%氰丙基苯基-94%二甲基聚硅氧烷为固定液(或极性相近);起始温度40℃,维持12分钟,以每分钟10℃的速率升温至240℃,维持10分钟,进样口温度为200℃,检测器温度为280℃,载气为氦气或氮气,进样体积1µL。
系统适用性要求:对照溶液(2)色谱图中,乙醛峰与甲醇峰之间的分离度应符合要求。
测定法:取供试品溶液(1)(2)与对照溶液(1)(2)(3)(4)分别注入气相色谱仪,记录色谱图。
限度:供试品溶液(1)如出现杂质峰,甲醇峰面积不得大于对照溶液(1)中甲醇峰面积的0.5倍(0.02%);含乙醛和乙缩醛的总量按公式(1)计算,总量不得过0.001%(以乙醛计);含苯按公式(2)计算,不得过0.0002%;供试品溶液(2)中其他杂质峰面积的和不得大于4-甲基-2-戊醇的峰面积(0.03%,以4-甲基-2-戊醇计)。
乙酸和乙缩醒的总含量%= +{×(Mr1/Mr2)}
式中,AE为供试品溶液(1)中乙醛的峰面积;
AT为对照溶液(2)中乙醛的峰面积;
CE为供试品溶液(1)中乙醛的峰面积;
AE为供试品溶液(1)中乙缩醛的峰面积;
CT为对照溶液(3)中乙缩醛的峰面积;
Mr1为乙醛的分子量,44.05。
Mr2为乙缩醛的分子量,118.2。
苯含量%=(0.0002%×BE)/(BT-BE)
式中,BE为供试品溶液(1)中苯的峰面积;
BT为对照溶液(4)中苯的峰面积。
不挥发物
取本品40mL,置105'C恒重的蒸发皿中,于水浴上蒸干后,在105°C干燥2小时,遗留残渣不得过1mg。
类别
消毒防腐药、溶剂。
贮藏
遮光,密封保存。
储存方法
存储于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。保持容器密封。应与氧化剂、酸类、碱金属、胺类等分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适的收容材料。
运输信息
危险货物编号:32061
UN编号:1170
包装标志:7(易燃液体)
包装类别:O52
包装方法:小开口钢桶;小开口铝桶;螺纹口玻璃瓶、铁盖压口玻璃瓶、塑料瓶或金属桶(罐)外木板箱。螺纹口玻璃瓶、塑料瓶或镀锡薄钢板桶(罐)外满底板花格箱、纤维板箱或胶合板箱。
运输注意事项:铁路运输时应严格按照铁道部《危险货物运输规则》中的危险货物配装表进行配装。本品运输时限使用钢制企业自备罐车装运,运装前需报有关部门批准。运输时运输车辆应配备相应品种和数量的消防器材及泄漏应急处理设备。夏天最好早晚运输。运输时所使用的的槽(罐)车应有接地链,槽内可设孔隔板以减少震荡产生静电。应单独运输,严禁与酸类、易燃物、有机物、氧化剂、自燃物品、遇湿易燃物品等并车混运。运输途中应防暴晒、雨淋、防高温。中途停留时应远离火种、热源、高温区。装运该物品的车辆排气管必须配备阻火装置,禁止使用易产生火花的机械设备和工具装卸。公路运输时要按照规定路线行驶,勿在居民区和人口稠密区停留。铁路运输时要禁止溜放。严禁用木船、水泥船散装运输。
乙醇含量的测定有物理方法和化学方法。物理方法有气相色谱法、密度瓶法、酒精计法、折射计测定法。化学方法有重铬酸钾比色法、莫尔盐法、碘量滴定法。
气相色谱法
样品在气相色谱仪中通过色谱柱时,由于在气固两相中吸附系数不同,而使乙醇与其他组分分离,利用氢火焰离子化检测器进行鉴定,用内标法定量。
标准溶液配制:用5个10.00 mL容量瓶分别准确量取10.00 mL不同浓度的乙醇标准溶液,再分别加入0.50 mL内标溶液,混匀。该溶液用于标准曲线的绘制。
试样制备:吸取10.00 mL样品于10.00 mL容量瓶中,准确加入0.50 mL内标溶液,混匀。
通过试验选择最佳色谱条件进样,使乙醇和内标物完全分离。分别吸取0.3 μL乙醇标准溶液,快速从进样口注入色谱仪,同时开启记录仪记录谱图。以标样峰面积和内标峰面积比值对乙醇浓度作标准曲线。用试样组分峰面积与内标峰面积的比值查标准曲线得出的值,乘以稀释倍数,即为试样中的乙醇含量。
密度瓶法
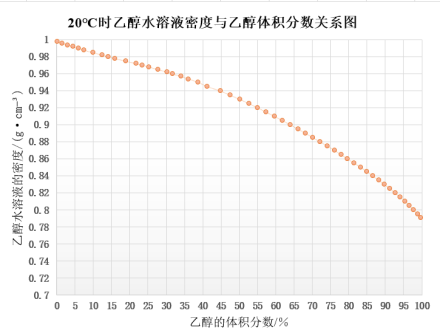
以蒸馏法去除样品中的不挥发性物质,用密度瓶法测定馏出液的密度。根据馏出液的密度,求得20 ℃时乙醇的体积百分数,即酒精度。
试样制备:20 ℃时准确量取一定量的样品于蒸馏瓶中,用水冲洗容量瓶,洗液并入蒸馏瓶中,连接冷凝器,以取样用的原容量瓶作接收器(外加冰浴),缓慢加热蒸馏。收集馏出液接近刻度,取下容量瓶,盖塞。在20 ℃水浴中保温30 min,补加水至刻度,混匀备用。
蒸馏水质量测定:将附温度计的密度瓶洗净烘干至恒重m。然后取下温度计,用煮沸冷却至15 ℃左右的蒸馏水注满密度瓶,插上带温度计的瓶塞,排除气泡。浸入20.0±0.1 ℃的恒温水浴中,待温度达20℃,并保持10 min不变后,用滤纸吸去侧管溢出的液体,使侧管中的液面与侧管管口齐平,立即盖好侧孔罩,取出密度瓶,用滤纸擦干瓶壁上的水,称量m1。
试样质量测定:将密度瓶中的水倒出,洗净并使之干燥,然后装满制备好的试样,按上述步骤操作,称量m2。
馏出液20 ℃时相对密度
式中:m为密度瓶的质量(g),m1为密度瓶和水的质量(g),m2为密度瓶和馏出液的质量(g)。根据馏出液的相对密度,查乙醇水溶液的相对密度与乙醇浓度换算表,得出试样乙醇含量。
酒精计法
以蒸馏法去除样品中的不挥发性物质,用酒精度表直接读取温度和酒精的示值,加以温度校正,求得20 ℃时乙醇的体积百分数,即酒精度。
将量筒中馏出液搅拌均匀,静置,排除气泡,轻轻放入洗净、擦干的酒精计,再略按一下,静置后,水平观测与弯月面相切处的刻度示值。同时测量温度,换算成20 ℃时乙醇的体积百分数。
浸入式折射计测定法
取除气样品,经过滤,用浸入式折射计测出20 ℃的折光率。乙醇含量A(g/100 g样品)可按下列公式计算:
式中:r0为浸入式折射计20℃时的读数减去14.5(20 ℃纯水在浸入式折射计中的读数),
重铬酸钾比色法
重铬酸钾能将乙醇氧化为乙酸,同时6价铬被还原为3价铬,可用比色法进行测定。化学反应式如下:
标准系列管配制:在10mL比色管中加入各溶液,如下表所示:
编号 | 0 | 1 | 2 | 3 | 4 | 5 |
体积分数0.1%的标准乙醇溶液(mL) | 0 | 1 | 2 | 3 | 4 | 5 |
水(mL) | 5 | 4 | 3 | 2 | 1 | 0 |
各管中加1mL 2%重铬酸钾溶液,5mL浓硫酸,摇匀。在沸水浴中加热10min,取出冷却。
试样制备:称取100g样品,置于500mL圆底烧瓶中,加200mL水,蒸馏,用100mL容量瓶正确接收流出液100mL,摇匀。吸取5mL馏出液,置于10mL比色管中,加1mL 2%重铬酸钾溶液,5mL浓硫酸,摇匀。与标准系列管一起在沸水浴中加热10min,取出冷却。
分光光度法测光密度:在600nm下测定光密度,绘制标准曲线,得出回归方程。根据回归方程计算5mL馏出液的乙醇含量。最后换算出100 g样品中的乙醇含量。
莫尔盐法
在酸性溶液中,乙醇被重铬酸钾氧化生成乙酸,过量的重铬酸钾溶液与莫尔盐(FeSO4·(NH4)2SO4·6H2O)作用,然后以赤血盐(K3Fe(CN)6)作外指示剂,与过量的莫尔盐起显色反应。
吸取10 mL试样于三角瓶中,瓶口装有玻璃弯管,插入盛有5 mL重铬酸钾溶液和2.5 mL浓硫酸的试管底部,将试管放入冷水中。当液体被蒸出2/3时停止蒸馏。将玻璃管取出,试管中液体倒入250 mL烧杯中,并用水洗净试管和玻璃管插入部分,然后用莫尔盐溶液滴定,不断搅拌,由黄色滴定至鲜绿色为止。同时用赤血盐作外指示剂进行斑点试验,即被滴定的溶液由黄逐渐变绿时,每滴定0.1~0.2 mL莫尔盐溶液,就要取一滴试样在白瓷板上观察颜色,斑点为浅蓝色即为终点(同时按上述方法用蒸馏水代替试样进行空白试验)。
试样中的乙醇含量可按下式计算:
式中:5为重铬酸钾溶液的体积,V1为空白试验消耗莫尔盐溶液体积,V2为滴定试样消耗莫尔盐溶液的体积,0.0126为与1 mL重铬酸钾溶液相当的乙醇体积;10为吸取试样的体积。
碘量滴定法
在酸性溶液中,乙醇被重铬酸钾氧化生成乙酸,过量的重铬酸钾溶液以碘化钾还原,析出的碘,以硫代硫酸钠溶液滴定。
取50 mL试样放入250 mL三角瓶中,加50 mL水,迅速蒸馏出50 mL备用。在两个250 mL碘量瓶中,各吸取10 mL 0.1 N重铬酸钾和5 mL浓硫酸,混匀冷却至室温。在一瓶中加入5 mL馏出液,另一瓶中加入5 mL水(空白试验)。混匀静置2 min,使乙醇完全氧化,然后分别加入4%碘化钾溶液10 mL,摇匀,置暗处5 min,再各加入约150 mL水,立即用0.1 N硫代硫酸钠滴定,当滴定至微黄绿色时,加入1%淀粉指示剂1 mL,继续滴定至呈现淡青绿色为终点。
试样中的乙醇含量可按下式计算:
式中:V1为空白试验消耗0.1 N硫代硫酸钠体积,V2为滴定馏出液消耗0.1 N硫代硫酸钠体积,0.00146为与1 mL 0.1 N硫代硫酸钠相当的乙醇体积,V为吸取馏出液的体积,F为0.1 N硫代硫酸钠的当量浓度校正系数。